A pesar de la reciente reactivación en el desarrollo de fármacos oftalmológicos, todavía quedan considerables necesidades sin cubrir en el sector de la oftalmología. De 2015 a 2018, se observó un aumento del 800% en la aprobación de nuevos medicamentos oftalmológicos en los EE.UU. Sin embargo, alrededor de 10 millones de adultos todavía padecen alguna forma de pérdida de la visión en los Estados Unidos, al igual que otras 2 mil millones de personas más en todo el mundo. Lo peor es que 1 mil millones de esas personas tienen una deficiencia visual prevenible o tratable que aún no ha sido atendida.
El envejecimiento de la población, sumado al aumento del tiempo frente a pantallas digitales y la presencia de la contaminación aérea produjeron el aumento de la incidencia de enfermedades oculares. Estos factores posicionaron a la industria en un inmenso crecimiento debido a que se expande para responder al aumento de necesidades. Ahora estamos siendo testigos de una gran parte de este crecimiento con dos aprobaciones de medicamentos oculares en el primer semestre de 2020. Además, existen al menos otros nueve productos oculares dispuestos a alcanzar los mayores objetivos este año. En esta publicación, el equipo de Salud de Lubrizol Life Science (LLS Health) analiza estos objetivos y sus implicancias.
Aprobaciones de medicamentos nuevos en 2020
- Medicamento inyectable de Tepezza® (teprotumumab-trbw) de Horizon Therapeutics
En enero de 2020, la FDA aprobó el medicamento inyectable Tepezza® (teprotumumab-trbw) de Horizon Therapeutics para el tratamiento de la enfermedad tiroidea ocular (TED, por sus siglas en inglés). La TED puede provocar pérdida de la visión y está asociada a otros síntomas debilitantes. El principio activo del medicamento inyectable de Tepezza, un anticuerpo monoclonal humano e inhibidor selectivo de un receptor del factor de crecimiento específico, es el primero de su clase. Es el único producto aprobado en los EE.UU. para tratar el raro trastorno autoinmunitario de la TED. La FDA le adjudicó varias denominaciones al medicamento, como medicamento huérfano, evaluación prioritaria, procedimiento acelerado y tratamiento innovador. El estado de evaluación prioritaria es una tendencia notable en oftalmología, particularmente para los inhibidores del factor de crecimiento vascular endotelial (FCVE). El medicamento inyectable Beovu® (brolucizumab) aprobado en 2019 es un ejemplo destacado.
- Implante de bimatoprost Durysta™ de Allergan
Unos meses después de la aprobación del medicamento inyectable de Tepezza, la FDA también aprobó el implante de bimatoprost Durysta™ de Allergan. El implante Durysta reduce la presión intraocular en pacientes con glaucoma. El implante Durysta reduce la presión intraocular en pacientes que padecen glaucoma. Es el único producto biodegradable de liberación mantenida que se puede implantar en la cavidad ocular, conocido como intracameral, para el glaucoma. El primer tratamiento novedoso para el glaucoma creado en más de 20 años logró comercializarse hace menos de tres años, por lo que el implante Durysta™ es especialmente destacado.
En las últimas décadas, el mercado oftalmológico se ha concentrado principalmente en cuatro áreas de enfermedades:
- Degeneración macular senil (DMS)
- Síndrome del ojo seco
- Retinopatía diabética
- Glaucoma
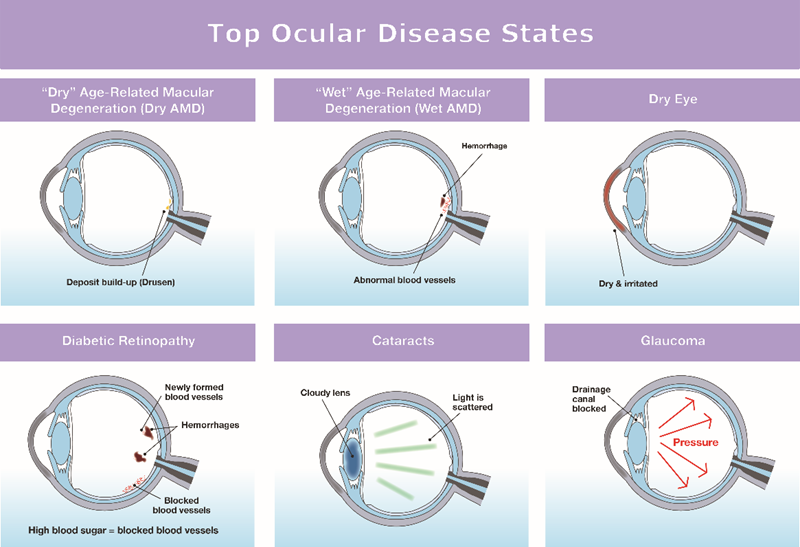
Figura 1: Principales estados de las enfermedades oculares
El 85% de los medicamentos oftálmicos en desarrollo son para tratar trastornos de la retina, la enfermedad del ojo seco y el glaucoma. Casi el 50% son para trastornos de la retina, principalmente retinopatía diabética y DMS, que es el área de enfermedad n.° 1 con medicamentos en desarrollo. La segunda área de enfermedad con productos en desarrollo es el glaucoma, que abarca alrededor del 20% de los medicamentos oculares en desarrollo. El ojo seco comprende el 15% de los productos oftálmicos en desarrollo. Las cataratas representan otra área con un número significativo de productos en desarrollo.
En esta publicación, nos centramos principalmente en la enfermedad del ojo seco y los trastornos de la retina, ya que son las áreas con mayor progreso este año. Los productos analizados abarcan nuevas entidades moleculares (NEM) y 505(b)(2) fórmulas de medicamentos inyectables, implantes y tópicos de venta con receta (Figura 2). También hay varios genéricos en desarrollo, entre los que se destacan los biosimilares y los genéricos de emulsión oftálmica de ciclosporina Restasis®. Los genéricos están fuera del análisis de esta publicación, sin embargo, si desea información adicional, nuestra publicación anterior menciona ese tema.
Este año ha registrado el mayor crecimiento de las NEM y de los principios activos de reutilización, además de algunos biosimilares. Sin embargo, esta innovación probablemente allane el camino para un auge de los genéricos oculares en un futuro próximo, especialmente para los productos biológicos. Los medicamentos inyectables Eylea® (aflibercept) y Lucentis® (ranibizumab) para tratar la DMS dejan de estar patentadas este año. Como proveedor de excipientes bioadhesivos de alta calidad para productos oculares y como organización de fabricación y desarrollo de medicamentos por contrato (CDMO) especializada en productos estériles, esperamos con interés nuestro posible aporte en este desarrollo.
Hitos e innovaciones
Síndrome del ojo seco
Las opciones de tratamiento para el síndrome de ojo seco consisten en medicamentos de venta libre y medicamentos de venta con receta. En el caso de los medicamentos de venta libre, las gotas oculares como Systane® y las gotas oculares lubricantes como Refresh® son los principales métodos de tratamientos y opciones a corto plazo si se las compara con los medicamentos de venta con receta. En el caso de los medicamentos de venta con receta, la emulsión oftálmica Restasis de Allergan, lanzada en 2003, fue el primer tratamiento para el ojo seco crónico.

La solución oftálmica de lifitegrast Xiidra® de Novartis en 2016 y la solución oftálmica de ciclosporina Cequa™ de Sun Pharma en 2019 siguieron al lanzamiento de la emulsión Restasis. Actualmente, en el mercado de medicamentos de venta con receta de los Estados Unidos, no hay otros tratamientos aprobados para el síndrome del ojo seco crónico. En consecuencia, muchas empresas están centrando sus esfuerzos en el área del ojo seco, lo cual deriva en una significativa innovación en esta área. Recientemente dos tratamientos para el ojo seco en fase avanzada alcanzaron importantes hitos en su desarrollo. El primer tratamiento es un corticoesteroide, y el segundo implica una novedosa vía de administración.
- Eysuvis™, suspensión oftálmica de loteprednol etabonato, de Kala Pharmaceutical
En mayo, Kala Pharmaceuticals volvió a presentar una solicitud de registro (NDA, por sus siglas en inglés) para su suspensión oftálmica de loteprednol etabonato 0.25%, la que ha sido aceptada por la FDA para su análisis. La nueva presentación para el tratamiento del ojo seco sobrevino después de que la FDA respondió la primera presentación a mediados de 2019. Los resultados positivos del ensayo clínico de fase 3 respaldan la NDA. La FDA fijó el mes de octubre como objetivo para completar su análisis, de conformidad con la Ley de Cargos para Usuarios de Fármacos Recetados (PDUFA, por sus siglas en inglés). - Aerosol nasal OC-01 de Oyster Point Pharma
En mayo, Oyster Point Pharma también anunció resultados alentadores del ensayo clínico de fase 3 de su aerosol nasal OC-01. La compañía declaró que durante los ensayos clínicos el medicamento demostró una mejora significativa en términos estadísticos en pacientes frente al grupo control. OC-01, un nuevo tipo de medicamente para el tratamiento del ojo seco, es un agonista selectivo del receptor de acetilcolina nicotínica. El componente del aerosol nasal del OC-01 también introduce una novedosa vía de administración. De aprobarse, esta combinación de innovaciones podría representar un paso significativo para el tratamiento del ojo seco. OC-01 podría allanar el paso a otras clases de medicamentos no analizados anteriormente para el tratamiento del ojo seco.
Trastornos de la retina
La retina es una fina capa de tejido que recubre la parte posterior del ojo y que convierte la luz en señales neuronales. Luego envía estas señales al cerebro para su reconocimiento. La retina es una parte esencial del ojo, y por eso, los signos de problemas retinianos son una de las principales causas de la pérdida de visión. Como consecuencia, en los últimos años los especialistas en desarrollo de fórmulas han concentrado grandes esfuerzos para tratar los trastornos de la parte posterior del ojo. Los medicamentos inyectables de gran éxito como Eylea® y Lucentis® son ejemplos claves. Es de esperar que en 2020 al menos siete tratamientos en investigación para abordar enfermedades de la retina alcancen hitos notables.
- Medicamento inyectable Eylea® (aflibercept) de Regeneron Pharmaceutical
Los ensayos clínicos de fase 3 para evaluar el medicamento inyectable Eylea en intervalos de administración de 12 semanas o más comenzarán este año. El medicamento inyectable Eylea está aprobado para tratar la degeneración macular senil húmeda y la retinopatía diabética acompañada de edema macular, pero no con el esquema posológico que se pretende administrar. Regeneron también informó recientemente sobre los resultados de dos años de su ensayo clínico de fase 3 en el que se está evaluando su medicamento inyectable Eylea para el tratamiento de la retinopatía diabética no proliferante en pacientes sin edema macular. - Sistema de administración Drug Delivery System® con brimonidina (Brimo DDS) de Allergan
Allergan declaró que su fármaco Brimo DDS para tratar la degeneración macular senil seca en estado avanzado está por pasar a la fase 3 de los ensayos clínicos en 2020. El implante utiliza brimonidina, una droga selectiva del receptor adrenérgico alfa 2 que tradicionalmente se ha usado para disminuir la presión intraocular en pacientes con glaucoma. El anuncio tuvo lugar después de que se dieran a conocer los resultados positivos de la fase 2A del ensayo clínico para el proyecto 505(b)(2). Actualmente no hay tratamientos aprobados para la DMS seca, a pesar de que abarca más del 80% de los casos de DMS. En consecuencia, Brimo DDS podría tener un efecto significativo en los pacientes con DMS. - OPT-302 de Opthea
Opthea completó los ensayos clínicos de fase 2B de OPT-302 en 2019 y prevé contar con datos destacados de la fase 2A a finales de este año. OPT-302 es una proteína de fusión que funciona como inhibidor del factor de crecimiento vascular endotelial (FCVE), un tipo de tratamiento cada vez más frecuente para abordar los trastornos de la retina. La compañía planea pasar a la fase 3 de su ensayo clínico. - KSI-301 de Kodiak Sciences
A principios de este año, Kodiak Sciences reveló que los estudios fundamentales del fármaco KSI-301 contra el FCVE comenzarían en 2020. De aprobarse, el medicamento tratará el edema macular diabético, la retinopatía diabética no proliferativa y la oclusión de la vena retiniana. KSI-301 está avalado en los resultados optimistas de la fase 1B de su ensayo clínico. - RBM 007 de Ribomic.
El estudio de fase 2 de Ribomic para evaluar a RBM-007 como tratamiento de la DMS húmeda incorporó a sus primeros pacientes a principios de este año. El proyecto es el producto más avanzado de la pequeña empresa incipiente japonesa, y RBM-007 sería su primer medicamento en comercializarse si finalmente se aprueba. La situación de empresa incipiente de Ribomic, junto con la situación de varias otras organizaciones señaladas, concuerda con una tendencia común en el mercado oftalmológico. Las compañías más pequeñas están ingresando cada vez más en el mercado oftalmológico y desplazando del dominio a las diez empresas más importantes. - RGX-314 de REGENXBIO
RGX-314 de REGENXBIO, otro fármaco en desarrollo para tratar la DMS húmeda, comenzará pronto su próxima etapa del ensayo clínico. REGENXBIO informó anteriormente resultados positivos de la fase 1/2A. El tratamiento génico es para la administración supracoroidea, es decir, para la administración entre las capas del globo ocular. - Sistema de administración por vía (Port Delivery System, PDS) de Roche y Genentech
El sistema de administración por vía (PDS) de Roche y Genentech por el cual se adminstra ranibizumab atraviesa dos ensayos clínicos de fase 3 diferentes. Un ensayo es para la DMS húmeda y el otro es para el edema macular diabético. El implante se realiza por vía quirúrgica y se recarga a través de inyecciones intravítreas.
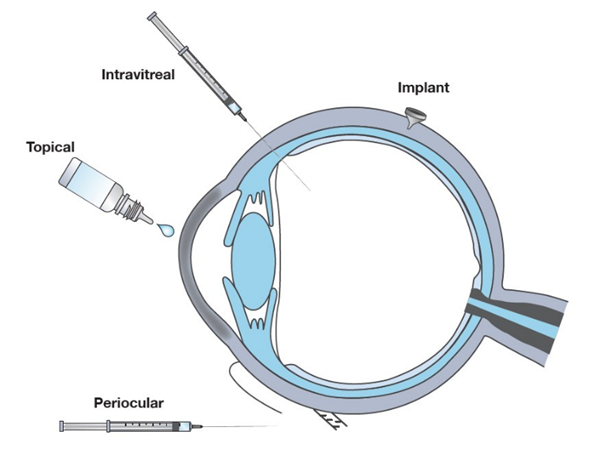
Figura 2: Formas farmacéuticas oculares frecuentes y vías de administración
El interés en el mercado oftalmológico se está fortaleciendo, tal como lo demuestra el significativo progreso ya realizado en 2020. Se están investigando y utilizando ampliamente las NEM y los principios activos de reutilización, posicionando al mercado oftalmológico en una etapa de crecimiento ahora y en el futuro. Los genéricos también contribuyen en los progresos realizados en el desarrollo ocular, y el mejor ejemplo es la inminente emulsión genérica Restasis y el despliegue publicitario en torno a quién será el primero en llegar al mercado. Sin embargo, es probable que veamos contribuir más a los genéricos en los próximos años, ya que la innovación actual está preparando el terreno para un auge de estos medicamentos.
Con todos estos factores, la industria y la innovación que la acompaña seguirán indudablemente desarrollándose y creciendo, y esto implica un progreso crucial para los pacientes. Este auge en el desarrollo de nuevos medicamentos es fundamental para dar apoyo a los consumidores de todo el mundo, ya que las carencias que tienen los pacientes nunca han sido tan altas. Solo el tiempo podrá confirmar si los medicamentos mencionados tendrán éxito y ayudarán a reducir la sorprendente cantidad de personas que sufren problemas de visión. A pesar de ello, LLS Health es optimista sobre el futuro de la oftalmología y se enorgullece del papel que desempeña en facilitarles a los pacientes tratamientos que con frecuencia les salvan la vista.
LLS Health tiene una larga historia en el suministro de excipientes oculares multifuncionales; nuestros polímeros bioadhesivos han permitido la fabricación de medicamentos oculares centrados en el paciente durante décadas. Además, ofrecemos polímeros de calidad médica y servicios de CDMO y nos especializamos en medicamentos complejos y estériles, como los inyectables intravítreos. Contáctenos hoy mismo para obtener información adicional.
Autor:
Ashley M. Rein | Especialista en Marketing Técnico


