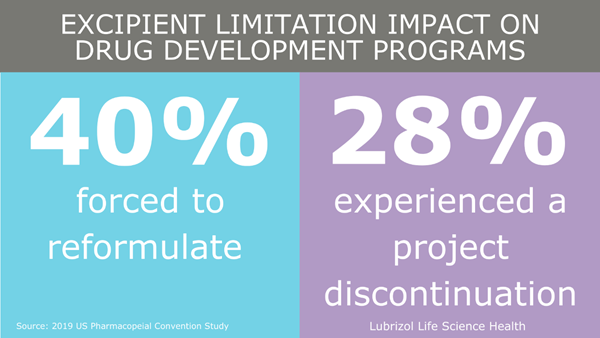
La selección y la calificación de los excipientes (componentes inactivos) para su uso en un medicamento son fundamentales para el éxito de cualquier programa de desarrollo farmacéutico. Los excipientes farmacéuticos son sustancias diferentes del principio activo cuya seguridad se ha evaluado y que se incluyen de manera intencionada en el sistema de administración de un fármaco. Los excipientes son fundamentales para asegurar las propiedades esenciales de un medicamento, por ejemplo, aumentar la biodisponibilidad o permitir la liberación controlada de un fármaco.
Sin embargo, el panorama regulatorio actual, o la falta de un proceso de aprobación independiente para excipientes, puede estar restringiendo la entrada de nuevos excipientes al mercado, y, posteriormente, de nuevos medicamentos. Nos reunimos con el Director de Estrategia Regulatoria y Normativa de Lubrizol Life Science Health (LLS Health), Meera Raghuram, para conversar acerca de la importancia de los excipientes nuevos y las acciones tomadas recientemente por la FDA.
P: ¿Qué es un nuevo excipiente, y cómo recibe aprobación un excipiente?
"Bueno, para empezar, en realidad es un error común pensar que los excipientes se 'aprueban'", dice Meera. "Los excipientes, o componentes inactivos, propiamente dichos nunca reciben aprobación de la FDA realmente. Los excipientes se revisan como componentes del medicamento terminado cuando se presenta una solicitud de registro de nuevo medicamento (NDA), una solicitud abreviada de registro de nuevo medicamento (ANDA) o una solicitud 505(b)(2). Esto sienta el precedente de uso del excipiente en un medicamento aprobado y, por lo tanto, el excipiente ya no se considera "nuevo" en esa vía de administración en particular y en los niveles máximos aprobados de consumo diario.
La frase "nuevo excipiente" por lo general hace referencia a un componente inactivo que no se ha usado anteriormente en un medicamento aprobado en los Estados Unidos. Sin embargo, los organismos reguladores pueden considerar "nuevo" un excipiente que no se ha usado en una vía de administración específica o en niveles que superan lo establecido en un medicamento aprobado. Incluso si un excipiente se ha usado mucho en otras aplicaciones no farmacéuticas aprobadas por la FDA, como alimentos o productos de venta libre, igual se considera "nuevo" cuando se utiliza en medicamentos sujetos a la aprobación regulatoria. En general, los fabricantes de medicamentos se resisten a usar un excipiente nuevo en un medicamento dado que no saben con certeza si la FDA consideraría adecuada la información disponible sobre la seguridad del excipiente en cuestión. La incertidumbre es mayor en el caso de medicamentos genéricos dado que los estudios preclínicos y clínicos no son obligatorios para obtener la aprobación regulatoria.
"Como actualmente no existe un proceso para la evaluación independiente de los excipientes, un excipiente ya no se considera nuevo solo cuando se encuentra presente en un medicamento aprobado y aparece en la base de datos de excipientes (IID) de la FDA", comenta Meera.
P: ¿Qué es la base de datos de excipientes (IID)?
La IID es un repositorio clave de información sobre excipientes que un desarrollador farmacéutico puede usar para evaluar posibles componentes inactivos para su formulación. Esta base de datos ofrece información sobre la máxima potencia por unidosis de excipiente en medicamentos aprobados en los Estados Unidos para una vía de administración específica.
"Una vez que un excipiente figura en la base de datos, requerirá una revisión menos exhaustiva por parte de la FDA la próxima vez que se incluya en un tipo similar de medicamento debido a que los antecedentes de uso y seguridad de una vía de administración específica ya se habrían establecido", explica Meera. "Por este motivo, es comprensible que los desarrolladores a menudo se inclinen por utilizar solo componentes incluidos en la IID incluso si no se cumple con todos los aspectos de rendimiento óptimo del fármaco en cuestión".
P: ¿Es un problema usar solo excipientes incluidos en la IID?
P: ¿Qué está haciendo la FDA para remediar la situación, y qué papel desempeña la industria?
"A partir de conversaciones con diversos interesados y teniendo en cuenta las inquietudes que expresaron, la FDA está considerando desarrollar un programa piloto para la evaluación toxicológica y de calidad de nuevos excipientes y ha solicitado el aporte de los interesados. El programa sería voluntario y permitiría la revisión de una cantidad limitada de presentaciones por año. Los proveedores y usuarios de excipientes, entre los que se incluyen LLS Health y asociaciones similares de la industria, han enviado comentarios en respuesta al programa propuesto por la FDA, la mayoría en apoyo al programa. El apoyo contundente prueba que definitivamente se necesita un programa de nuevos excipientes como este".
P: ¿Cuáles son los posibles beneficios de un programa de revisión de nuevos excipientes?
"Un programa como este podría liberar un enorme potencial que no se había explotado antes a la hora de desarrollar nuevos productos y opciones de tratamiento. El reconocimiento regulatorio de estos excipientes nuevos e importantes en una etapa temprana del desarrollo ayudará a que se tenga más en cuenta su aplicación, lo que generará mayor versatilidad en el método de fabricación y la vía de administración de los fármacos", opina Meera.
Tal como se resume en los comentarios enviados a la FDA, los posibles beneficios para futuros medicamentos como resultado del programa de revisión de nuevos excipientes podrían incluir los siguientes:
- Mejor rendimiento de los productos en términos de estabilidad, solubilidad, administración, etc.
- Reducción de los costos de desarrollo en general, lo que puede garantizar un acceso más rápido y económico a nuevos tratamientos para los pacientes
- Posibilidad de extender la liberación de los fármacos durante períodos más prolongados o para una administración más selectiva de los medicamentos, lo que mejoraría el cumplimiento de los pacientes
- Más opciones de formulación con productos combinados o al rediseñar fármacos para una nueva forma farmacéutica o vía de administración
- Nuevas capacidades para disuadir el uso indebido en el caso de fármacos que se prestan para el uso indebido por parte de los pacientes, como los opioides
P: ¿Qué está haciendo LLS Health en el ámbito de los nuevos excipientes?
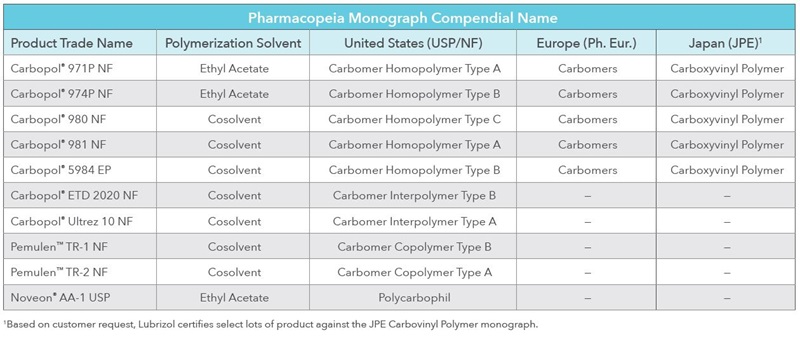
"LLS Health ofrece diversos excipientes para múltiples formas farmacéuticas, muchos de los cuales figuran en la IID y cuentan con antecedentes de uso en medicamentos aprobados. Estamos comprometidos a colaborar con nuestros clientes para introducir las mejores opciones de tratamiento en el mercado. Garantizar que nuestros clientes estén equipados con opciones adecuadas de excipientes es una parte esencial de ese compromiso. Por ese motivo, apoyamos la creación de este nuevo programa de la FDA", afirma Meera.
Muchos excipientes de LLS Health aún no se incluyeron en la IID, pero igual tienen posibilidades de ofrecer beneficios considerables para las formulaciones, entre los que se cuentan los siguientes:
- Mejor adhesión a las mucosas o membranas biológicas (mucoadhesión o bioadhesión)
- Liberación del fármaco mejor controlada y penetración optimizada en el tejido específico
- Mayor versatilidad de procesamiento, como en el caso de los polímeros que facilitan la dispersión en agua o que directamente pueden comprimirse en comprimidos (Carbopol® Ultrez 10 y 71G NF)
- Mejor control reológico y modificación de la viscosidad con una estética y una sensación óptimas
Autores:
Meera Raghuram | Directora de Política y Estrategia Regulatorias
Ashley M. Rein | Especialista en Marketing Técnico
Referencias: